Le cours⚓
L'essentiel de ce qu'il faut retenir
Un peu d'histoire⚓
Dès l’Antiquité, les philosophes grecs se sont interrogés sur la constitution de la matière. Thales de millet (le même qu'en mathématiques) et Empédocle énoncèrent la théorie des 4 éléments, théorie selon laquelle, tous les corps sont formés exclusivement de 4 éléments : l’eau, la terre, le feu et l’air.
Au IVème siècle avant J.-C., Démocrite, un autre philosophe grec, émit l’idée que la matière était constituée de petites particules indivisibles appelé « atomos » (insécable en grec !). Malheureusement la faible notoriété de Démocrite comparée à celle d’Aristote partisan de la théorie des 4 éléments, mit à mal la théorie de Démocrite.
Pendant plus de 22 siècles, la théorie des 4 éléments fut celle communément admise et reconnue. Il faudra attendre le XIXème siècle et les travaux expérimentaux de John Dalton, père de la théorie atomiste, pour prouver que la théorie des 4 éléments était fausse et que la matière était constituée d’atomes.
Au cours du XXème siècle, plusieurs scientifiques ont proposé leur modèle de l’atome au fur et à mesure que les connaissances ont évoluées. Voici une petite infographie sur l'histoire de ces modèles.
En 3ème, on s'intéresse plus particulièrement au modèle de Rutherford aussi appelé le modèle planétaire.
La structure de l'atome⚓
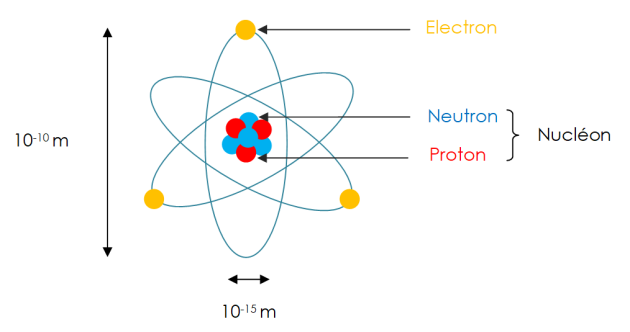
Définition : Le modèle de Rutherford ou modèle planétaire
Un atome est constitué d’électrons (particules chargées négativement) en mouvement dans le vide autour d’un noyau central chargé positivement.
Un atome étant électriquement neutre, il contient autant de charges positives (protons) dans son noyau que d'électrons négatifs autour. Sa charge électrique globale est donc nulle. Une charge positive compense une charge négative.
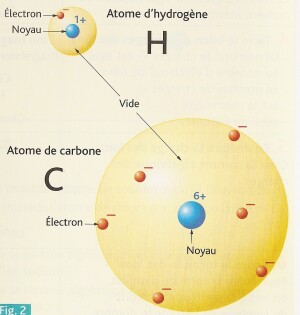
L'atome d'hydrogène, de symbole H, contient 1 proton (charge positive) dans son noyau et 1 électron négatif autour.
L'atome de carbone, de symbole C, contient 6 protons (charges positives) dans son noyau et 6 électrons négatifs autour.
Exemple : Avec l'atome de sodium
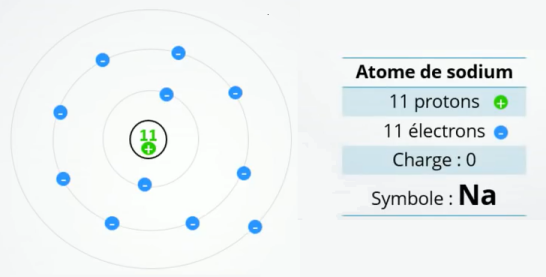
Il y a 11 protons positifs dans le noyau et donc 11 électrons autour. En calculant le bilan des charges on trouve bien que 11 \(\oplus\) + 11 \(\ominus\) = 0. La charge électrique globale de l'atome de sodium est donc bien nulle.
Définition : Et dans le noyau ?
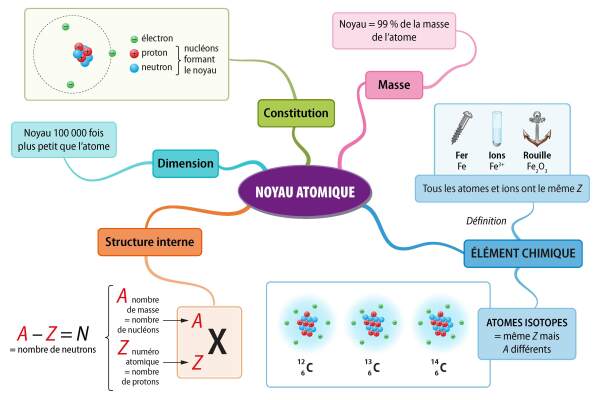
Le noyau d'un atome contient déjà les particules de charges positives appelées des protons. Il contient également des particules neutres électriquement (ni positives, ni négatives) appelées des neutrons.
L'ensemble des particules (protons et neutrons) du noyau s'appellent des nucléons (du latin « nucléus » = noyau).
Définition : Les dimensions de tout cela ?
Le diamètre de l’atome est de l’ordre de 10-10 m soit 0,1 nm (nanomètre).
Le noyau de l'atome est 100 000 fois plus petit que l'atome lui-même soit environ 10-15 m.
Malgré sa toute petite taille, le noyau est ce qui constitue l'essentiel de la masse d'un atome. Les électrons, même nombreux, sont bien plus petits que le noyau et ne pèsent quasiment rien comparativement au noyau. Le noyau représente environ 99 % de la masse d'un atome.
Notation symbolique d'un élément chimique⚓
Dans la classification périodique des éléments, on trouve les 118 éléments chimiques connus. On les représente en utilisant une notation un peu particulière qui permet, en coup d'œil, de connaître la constitution complète de l'atome.
Définition :
Chaque élément est repéré avec un symbole que tu as déjà rencontré en 4ème : (H pour hydrogène,, C pour Carbone, Fe pour fer, Cu pour cuivre...).
En indice de ce symbole on inscrit le numéro atomique qu'on appelle Z. Ce numéro indique le nombre de protons (charges positives) contenues dans le noyau.
Comme on sait que l'atome est électriquement neutre, on peut en déduire le nombre d'électrons entourant l'atome.
En exposant du symbole on indique le nombre de masse noté A. Il indique le nombre total de nucléons présents dans le noyau c'est-à-dire le nombre de protons ET de neutrons. Il s'appelle le nombre de masse car je te rappelle que c'est le noyau qui fait l'essentiel de la masse d'un atome.
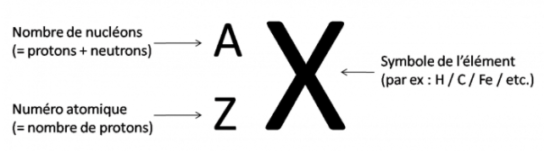
On peut donc déduire le nombre de neutrons N par une simple soustraction : N = A - Z.
Exemple : avec l'élément oxygène
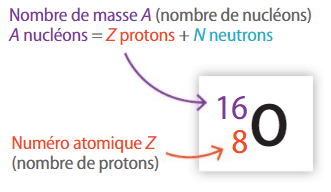
Le symbole de l'élément oxygène est O mais ça, tu le savais déjà !.
Le numéro atomique est Z = 8. Il y a donc 8 protons positifs dans le noyau de l'atome d'oxygène. Comme un atome est électriquement neutre, il y a également 8 électrons négatifs autour de ce noyau.
Le nombre de masse est A = 16. Il y a donc 16 nucléons dans le noyau. Comme il y a déjà 8 protons, on en déduit qu'il y a 8 neutrons (sans charge électrique) dans le noyau (N = A - Z = 16 - 8 = 8).
On peut donc représenter un atome d'oxygène comme ceci :
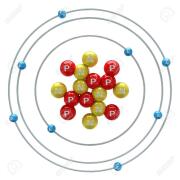
Les protons positifs sont représentés en rouge avec la lettre P.
Les neutrons neutres sont représentés en jaune avec la lettre N.
Les électrons négatifs sont représentés en bleu avec la lettre E.